WSTĘP
Gruźlica pozapłucna u dzieci występuje bardzo rzadko, chociaż w ostatnich latach zwiększyła się liczba wykonywanych badań diagnostycznych w kierunku tej choroby z uwagi na konieczność różnicowania z nieswoistym zapaleniem jelit (NZJ). Źródłem infekcji jelitowej może być zakażona plwocina, spożycie zakażonego mleka lub innego pokarmu. Zakażenie jelita może także nastąpić na drodze krwionośnej i/lub przez ciągłość z zajętym narządem [1]. Według analizy autopsyjnej Ridaura‑Sanz i wsp. zmiany w jelitach stwierdzono aż u 37,5% dzieci z gruźlicą, które w większości były diagnozowane z powodu zmian płucnych [2]. Ponadto wobec narastającej liczby dzieci leczonych biologicznie (przeciwciała anty‑TNF‑α) z powodu NChZJ, istnieje zwiększone ryzyko reaktywacji zakażenia prątkiem [3]. Oszacowano, że w porównaniu z monoterapią anty‑TNF‑α, ryzyko gruźlicy u pacjentów poddanych terapii łączonej anty‑TNF‑α z lekiem immunosupresyjnym, jak metotreksat czy azatiopryna zwiększa się nawet 13‑krotnie [4].
OBRAZ KLINICZNY
Gruźlica jelit (GJ) jest chorobą przewlekłą z podstępnym początkiem, rzadko ostrym lub podostrym. Wyróżnia się postać pierwotną GJ, czyli rozwijającą się po pierwszym kontakcie z prątkami, oraz wtórną, która jest wynikiem reaktywacji dotychczas latentnego zakażenia pierwotnego. U większości pacjentów z GJ do ustalenia rozpoznania dochodzi najczęściej z kilkunastomiesięcznym z opóźnieniem. To z kolei prowadzi do niepotrzebnych operacji i zwiększonej śmiertelności [5, 6]. Kliniczna manifestacja GJ u dzieci jest podobna do choroby Leśniowskiego‑Crohna (ChLC). Na podstawie obserwacji dzieci z gruźlicą przewodu pokarmowego stwierdzono, iż najczęściej zgłaszają one ból oraz wzdęcie brzucha, osłabienie i spadek masy ciała, natomiast rzadziej obserwowano gorączkę, biegunkę, krew w stolcu i objawy ostrego brzucha [6, 7]. Ponadto w niektórych przypadkach palpacyjnie badano opór w prawym dolnym kwadrancie jamy brzusznej lub stwierdzano płyn w jamie brzusznej w badaniach obrazowych [2, 7, 8]. W przeciwieństwie do pacjentów z ChLC, zmiany okołoodbytowe były w GJ objawem zdecydowanie nietypowym [7]. Według Mirza i wsp. najczęstszymi objawami GJ wymagającymi zabiegu chirurgicznego były: ostre zapalenie otrzewnej, perforacja jelit i całkowita niedrożność jelit [9]. W badaniach Ridaura‑Sanz i wsp. zaobserwowano, iż dzieci z postacią pierwotną GJ częściej miały objawy niedrożności jelit, a rzadziej krwawienie z przewodu pokarmowego, niż pacjenci z wtórną postacią GJ [2]. W przebiegu GJ oprócz objawów związanych z przewodem pokarmowym mogą występować też objawy pozajelitowe, jak rumień guzowaty oraz powikłania zakrzepowo-zatorowe [10].
BADANIA DIAGNOSTYCZNE GJ
W przypadku podejrzenia GJ w pierwszej kolejności powinny być wykonane testy skriningowe, czyli odczyn tuberkulinowy (TST) oraz testy uwalniania interferonu‑gamma (IGRA). Odczyn tuberkulinowy jest dodatni u większości chorych na gruźlicę jelitową, ale ma ograniczoną wartość diagnostyczną, ponieważ nie różnicuje aktywnej postaci choroby od wcześniejszego szczepienia lub kontaktu z patogennym prątkiem [10, 11]. Testy IGRA mają większą swoistość niż TST w diagnostyce utajonej postaci GJ i są użyteczne u osób po szczepieniach BCG, chociaż podobnie jak TST nie są w stanie odróżnić aktywnej postaci choroby od utajonej [12, 13].
Badania radiologiczne i endoskopowe są bardzo pomocne w diagnostyce GJ, jednak nie pozwalają na definitywne rozpoznanie choroby. Okolica krętniczo‑kątnicza jest najczęstszą lokalizacją zmian w jelicie (16‑40% dzieci). Rzadziej występują odcinkowe zmiany w jelicie grubym (ok. 20% przypadków) lub zajęcie odbytnicy i jelita cienkiego [7, 14]. Zarówno obraz radiologiczny, jak i endoskopowy może przypominać zmiany
stwierdzane w ChLC. W tabeli 1 i 2 zamieszczono cechy różniące obie te choroby. Spośród badań radiologicznych aktualnie rekomendowane jest wykonanie enterografii metodą rezonansu magnetycznego lub tomografii komputerowej, które wykazują u dzieci z GJ typowe okrężne pogrubienie ściany jelita w kątnicy i końcowym odcinku jelita krętego [15]. Charakterystyczną cechą jest też w przeciwieństwie do ChLC brak widocznych warstw w pogrubiałej ścianie jelita objętego gruźlicą. O aktywnym zapaleniu świadczy wzmocnienie sygnału ściany jelita po podaniu środka kontrastowego, natomiast brak wzmocnienia wskazuje na zwłóknienie ściany jelita. Względnie często w GJ występują niedrożność jelita i perforacja, podczas gdy nietypowe są przetoki i ropnie. Badanie radiologiczne z barytem, obecnie rzadziej wykonywane, może wykazać w GJ zniekształcenie zarysów jelita oraz zastawki krętniczo‑kątniczej, z obecnością owrzodzeń [15].
Badanie kolonoskopowe umożliwia nie tylko zobrazowanie zmian zapalnych, ale też pobranie wycinków do dalszej oceny histopatologicznej i identyfikacji prątków.
Wśród objawów endoskopowych GJ można wyróżnić zmiany o charakterze owrzodzeń (60%), zmiany przerostowe (10%) w postaci bliznowacenia, włóknienia i pseudoguzów oraz zmiany mieszane wrzodziejąco‑przerostowe (30%) wokół zastawki krętniczo‑kątniczej z pogrubieniem i owrzodzeniem
ściany jelita [1]. Zastawka krętniczo‑kątnicza może być zdeformowana i czasami nieruchomo otwarta lub mieć wygląd ziejącej z powodu pociągania przez otaczającą zmienioną bliznowato błonę śluzową. Owrzodzenia w GJ mają kształt okrężny względem długiej osi kanału jelita i stanowią jedyną i najważniejszą endoskopową wskazówkę w różnicowaniu z ChLC. Błona śluzowa otaczająca owrzodzenia jest zmieniona zapalnie i granulowana. Ponadto w GJ znacznie rzadziej niż w ChLC są obserwowane afty (u mniej niż 20% pacjentów) [1, 7]. Zwężenie dystalnego odcinka jelita krętego opisywane było u ok. 20% dzieci z GJ [7, 15].
Ostateczne rozpoznanie GJ powinno być potwierdzone obecnością ziarniniaków serowaciejących lub pałeczek kwasoopornych zidentyfikowanych podczas badania histopatologicznego w bioptatach pobranych w czasie kolonoskopii lub po izolacji prątków gruźlicy w hodowli tkankowej. Cechy morfologiczne, które pomagają odróżnić gruźlicze zapalenie jelita od innych chorób ziarniniakowych, obejmują: zlewne ziarniniaki, ziarniniaki o średnicy > 400 μm, więcej niż 5 ziarniniaków w bioptacie z jednego segmentu jelitowego oraz ziarniniaki zlokalizowane w błonie podśluzowej [16].
W codziennej praktyce wyniki powyższych badań są pozytywne tylko u 40‑47% dzieci z GJ [7, 14]. Ostatnio donoszono o oznaczeniu DNA prątków gruźlicy metodą PCR. Niestety wykorzystanie PCR w praktyce klinicznej wymaga walidacji, a fałszywie dodatnie wyniki PCR ograniczają użyteczność tej metody [8].
Tabela 1. Różnice w obrazie radiologicznym pomiędzy gruźlicą jelita a chorobą Leśniowskiego‑Crohna
[15]
Table 1. Differences in radiologic features between intestinal tuberculosis and Crohn’s disease [15]
| Zmiany radiologiczne | Gruźlica jelit | Choroba Leśniowskiego-Crohna |
| Lokalizacja | Kątnica częściej niż jelito kręte | Jelito kręte częściej niż kątnica |
| Rozległość zajętego odcinka jelita | Krótkie odcinki | Długie odcinki |
| Zajęcie kilku odcinkow jelita | Nietypowe (< 4 odcinkow) | Typowe |
| Nieciągłość zmian | Rzadko | Często |
| Warstwowość ściany | Rzadko widoczna | Często widoczna |
| Przetoki okołoodbytowe | Nietypowe | Typowe |
| Ropnie krezki | Bardzo rzadko | Mogą wystąpić |
| Przetoki między pętlami jelit | Rzadko | Często |
| Zwężenia | Centryczne | Ekscentryczne z powstaniem uchyłka |
| Zwiększenie ukrwienia krezki | Nietypowe | Typowe |
| Proliferacja włóknisto-tłuszczowa | Nietypowa | Typowa |
| Węzły chłonne krezki | Duże, z martwicą | Małe, jednorodne |
| Płyn w jamie brzusznej | Często | Rzadko |
| Zajęcie innych narządów | Może wystąpić | Bardzo rzadko |
DIAGNOSTYKA RÓŻNICOWA GJ
Diagnostyka różnicowa GJ u dzieci obejmuje ChLC, choroby infekcyjne jelit, jak promienica (aktynomikoza), histoplazmoza, amebioza i jersinioza oraz zapalenie kątnicy w przebiegu neutropenii, chłoniaka, torbiel zastoinową błony śluzowej jelita i zmiany polekowe. Spośród wymienionych, różnicowanie z chorobą ChLC stanowi najczęstsze wyzwanie dla klinicysty. W tabeli 1 i 2 zestawiono różnice w obrazie radiologicznym i endoskopowym w GJ i ChLC. W obrazie endoskopowym nie ma pojedynczej zmiany różnicującej jednoznacznie te dwie choroby, stąd konieczne jest uwzględnienie wyników wszystkich wykonanych badań obrazowych i mikrobiologicznych we wstępnej diagnostyce różnicowej. Okrężne owrzodzenia, blizny, pseudouchyłki i ziejąca zastawka krętniczo‑kątnicza są obserwowane częściej w GJ niż w ChLC, podczas gdy podłużne owrzodzenia, obecność zmian odcinkowych i aft, brukowanie błony śluzowej, pseudopolipy i wieloodcinkowość zmian oraz zajęcie okolicy odbytniczo‑odbytowej są bardziej typowe w ChLC niż GJ. Ogniskowe występowanie zmian jest powszechniejsze w GJ niż ChLC, z drugiej strony – zmiany obejmujące całe segmenty jelita częściej występują w ChLC niż w GJ (tab. 2).
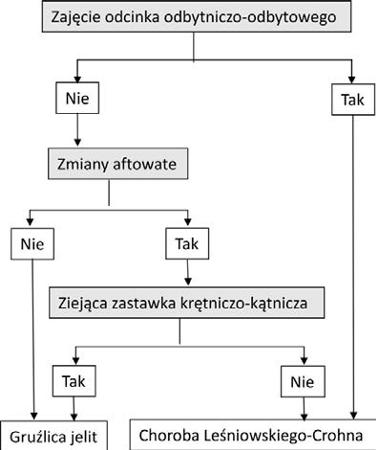
Park i wsp. zaproponowali algorytm różnicowania GJ z ChLC, wykorzystujący tylko trzy zmienne: zmiany odbytniczo‑odbytowe, afty i ziejąca zastawka krętniczo‑kątnicza, która umożliwia prawidłowe rozpoznanie GJ lub ChLC u 82% pacjentów (ryc. 1) [17].
Tabela 2. Diagnostyka różnicowa gruźlicy jelit (GJ) i choroby Leśniowskiego‑Crohna (ChLC) na podstawie obrazu kolonoskopowego [17, 20]
Table 2. Endoscopic differential diagnosis for intestinal tuberculosis (GJ) and Crohn’s disease (ChLC) [17, 20]
|
(A) Zmiany sugerujące GJ |
(B) Zmiany sugerujące chorobę ChLC |
|
Zajęcie mniej niż 4 segmentow jelita1 |
Zajęcie okolicy odbytniczo-odbytowej |
|
Ziejąca zastawka krętniczo-kątnicza |
Podłużne owrzodzenia |
|
Poprzeczne owrzodzenia |
Aftowate owrzodzenia |
|
Blizna lub pseudopolip |
Brukowanie błony śluzowej |
|
Rozpoznanie prawdopodobne |
|
|
1. Gruźlica jelit: liczba zmian (A) > liczba zmian (B) |
|
|
2. Choroba Leśniowskiego‑Crohna: liczba zmian (A) < liczba zmian (B) |
|
|
3. Rozpoznanie nieokreślone: liczba zmian (A) = liczba zmian (B) |
|
|
1 Segmenty jelita: odcinek krętniczo-kątniczy, wstępnica, poprzecznica, zstępnica, esica, odcinek odbytniczo-odbytowy. |
|
Ryc. 1. Algorytm z uwzględnieniem trzech cech stwierdzanych w kolonoskopii do różnicowania gruźlicy jelit i choroby Leśniowskiego‑Crohna [17, 20].
Fig. 1. Ileocolonoscopy‑based algorithm for differential diagnosis between intestinal tuberculosis and Crohn’s disease [17, 20].
LECZENIE
Standardowe leczenie gruźliczego zapalenia jelit obejmuje konwencjonalną terapię 4‑lekową (ryfampicyna, izoniazyd, pyrazynamid, etambutol) przez 2 miesiące, następnie izoniazyd z ryfampicyną przez kolejne 4‑7 miesięcy [18]. Większość pacjentów z łagodnym lub umiarkowanym zwężeniem jelita może być leczonych nieoperacyjnie.
Natomiast u osób z wieloma zwężeniami może być konieczna resekcja zmienionego odcinka jelita, uwzględniająca wykonanie miejscowej plastyki zwężeń w celu uniknięcia dużej resekcji [19]. Z uwagi na trudności w zidentyfikowaniu prątków gruźlicy i ustaleniu definitywnego rozpoznania, rozpoczęcie empirycznej terapii przeciwgruźliczej jest wykorzystywane w sytuacji, gdy istnieje duże prawdopodobieństwo takiego rozpoznania w oparciu o objawy kliniczne, radiologiczne i endoskopowe (przy braku potwierdzenia histopatologicznego i/lub mikrobiologicznego). Poprawę kliniczną uzyskuje się w ciągu 2 tygodni terapii empirycznej, a całkowite wyleczenie aktywnych owrzodzeń i nadżerek w kontrolnym badaniu kolonoskopowym po 2‑3 miesiącach terapii przeciwgruźliczej. W przypadku braku odpowiedzi na leczenie należy podejrzewać gruźlicę oporną na zastosowane leki lub zapalenie jelit o innym podłożu.
Piśmiennictwo
1. Marshall J.B.: Tuberculosis of the gastrointestinal tract and peritoneum. Am J Gastroenterol 1993, 88, 989‑999.
2. Ridaura‑Sanz C., López‑Corella E., Lopez‑Ridaura R.: Intestinal/Peritoneal tuberculosis in children: an analysis of autopsy cases. Tuberc Res Treat 2012, 2012, 230814.
3. Zhang Z., Fan W., Yang G., Xu Z., Wang J., Cheng Q. i wsp.: Risk of tuberculosis in patients treated with TNF‑α antagonists: a systematic review and meta‑analysis of randomised controlled trials. BMJ Open 2017, 7, e012567.
4. Lorenzetti R., Zullo A., Ridola L., Diamanti A.P., Laganà B., Gatta L. i wsp.: Higher risk of tuberculosis reactivation when anti‑TNF is combined with immunosuppressive agents: a systematic review of randomized controlled trials. Ann Med 2014, 46, 547‑554.
5. Dones P., Di Gangi M., Failla M.C., Genova S., Giannitto C., Corsello G. i wsp.: Intestinal tuberculosis in a child living in a country with a low incidence of tuberculosis: a case report. BMC Res Notes 2014, 7, 762.
6. Tinsa F., Essaddam L., Fitouri Z., Brini I., Douira W., Ben Becher S. i wsp.: Abdominal tuberculosis in children. J Pediatr Gastroenterol Nutr 2010, 50, 634‑638.
7. Singh S.K., Srivastava A., Kumari N., Poddar U., Yachha S.K., Pandey C.M.: Differentiation between Crohn’s Disease and Intestinal Tuberculosis in Children. J Pediatr Gastroenterol Nutr 2017 doi: 10.1097/
MPG.0000000000001625. [Epub ahead of print]
8. Donoghue H.D., Holton J.: Intestinal tuberculosis. Curr Opin Infect Dis 2009, 22, 490‑496.
9. Mirza B., Ijaz L., Saleem M., Sheikh A.: Surgical aspects of intestinal tuberculosis in children: our experience. Afr J Paediatr Surg 2011, 8, 185‑189.
10. Chiappini E., de Martino M., Mangiantini F., Lionetti P.: Crohn disease and mycobacterial infection in children: an intriguing relationship. J Pediatr Gastroenterol Nutr 2009, 49, 550‑558.
11. Kapoor V.K.: Abdominal tuberculosis. Postgrad Med J 1998, 74, 459‑467.
12. Ge L., Ma J.C., Han M., Li J.L., Tian J.H.: Interferon‑γ release assay for the diagnosis of latent Mycobacterium tuberculosis infection in children younger than 5 years: a meta‑analysis. Clin Pediatr (Phila) 2014, 53, 1255‑1263.
13. Lewinsohn D.M., Leonard M.K., LoBue P.A., Cohn D.L., Daley C.L., Desmond E. i wsp.: Official American Thoracic Society/Infectious Diseases Society of America/Centers for Disease Control and Prevention Clinical Practice Guidelines: Diagnosis of Tuberculosis in Adults and Children. Clin Infect Dis 2017, 64, 111‑115.
14. Malik R., Srivastava A., Yachha S.K., Poddar U., Lal R.: Childhood abdominal tuberculosis: Disease patterns, diagnosis, and drug resistance. Indian J Gastroenterol 2015, 34, 418‑425.
15. Sharma R., Madhusudhan K.S., Ahuja V.: Intestinal tuberculosis versus Crohn’s disease: Clinical and radiological recommendations. Indian J Radiol Imaging 2016, 26, 161‑172.
16. Pulimood A.B., Peter S., Ramakrishna B., Chacko A., Jeyamani R., Jeyaseelan L. i wsp.: Segmental colonoscopic biopsies in the differentiation of ileocolic tuberculosis from Crohn’s disease. J Gastroenterol Hepatol 2005, 20, 688‑696.
17. Park J.J., Cheon J.H.: Differential diagnosis: Intestinal tuberculosis; [w:] Kim W.H., Cheon J.H. (red.): Atlas of inflammatory bowel diseases, Springer, 2015, 71‑85.
18. Makharia G.K., Ghoshal U.C., Ramakrishna B.S., Agnihotri A., Ahuja V., Chowdhury S.D. i wsp.: Intermittent Directly Observed Therapy for Abdominal Tuberculosis: A Multicenter Randomized Controlled Trial
Comparing 6 Months Versus 9 Months of Therapy. Clin Infect Dis 2015, 61, 750‑757.
19. Aston N.O.: Abdominal tuberculosis. World J Surg 1997, 21, 492‑499.
20. Lee Y.J., Yang S.K., Byeon J.S., Myung S.J., Chang H.S., Hong S.S. i wsp.: Analysis of colonoscopic findings in the differential diagnosis between intestinal tuberculosis and Crohn’s disease. Endoscopy 2006, 38, 592‑597.
Autorzy:
Urszula Daniluk1, Ariel Płotko2, Piotr Jakimiec1, Aleksandra Filimoniuk1, Dariusz Marek Lebensztejn1
1 Klinika Pediatrii, Gastroenterologii i Alergologii Dziecięcej, Uniwersytet Medyczny w Białymstoku
Kierownik Kliniki: prof. dr hab. n. med. Dariusz Marek Lebensztejn
2 Oddział Chorób Płuc i Gruźlicy, Uniwersytecki Dziecięcy Szpital Kliniczny w Białymstoku
Kierownik Oddziału: dr n. med. Bożena Nowowiejska
Przedruk z: Gastroenterologia Praktyczna 2017, nr 2, s. 64-68.





